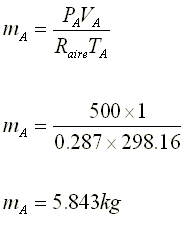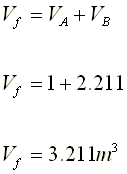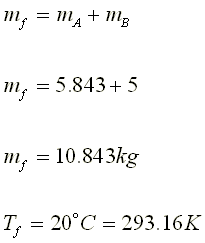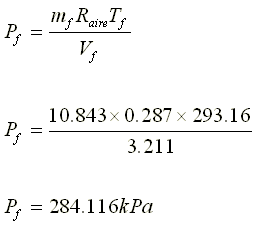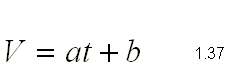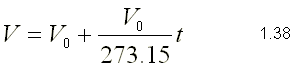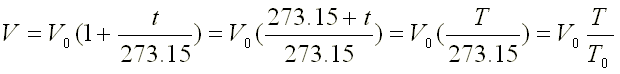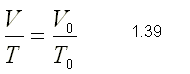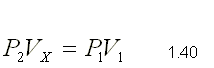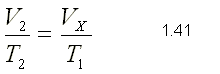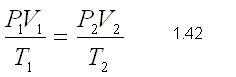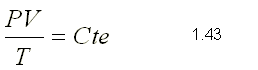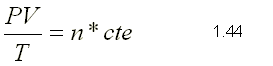1.- Una cantidad de gas ocupa un volumen de 80
cm3 a una presión de 750 mm Hg. ¿Qué volumen ocupará a una presión
de 1,2 atm.si la temperatura no cambia?
Como la temperatura y la masa permanecen constantes en el
proceso, podemos aplicar la ley de Boyle: P1.V1 = P2.V2
Tenemos que
decidir qué unidad de presión vamos a utilizar. Por ejemplo atmósferas.
Como 1 atm = 760 mm Hg, sustituyendo en la ecuación de
Boyle:
2.- El volumen inicial de una cierta cantidad
de gas es de 200 cm3 a la temperatura de 20ºC. Calcula el volumen a
90ºC si la presión permanece constante.
Como la presión y la masa permanecen
constantes en el proceso, podemos aplicar la ley de Charles y Gay-Lussac:
V1/T1=V2/T2
El volumen lo podemos expresar en cm3 y, el
que calculemos, vendrá expresado igualmente en cm3, pero la
temperatura tiene que expresarse en Kelvin.
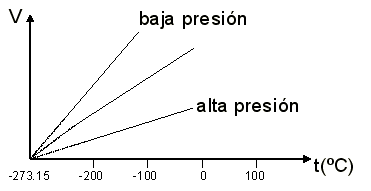
3.- Una cierta cantidad de gas se encuentra a
la presión de 790 mm Hg cuando la temperatura es de 25ºC. Calcula la presión
que alcanzará si la temperatura sube hasta los 200ºC.
Como el volumen y la masa permanecen constantes en el proceso, podemos
aplicar la ley de Gay-Lussac:
P1/T1=P2/T2
La presión la podemos expresar en mm Hg y, la que
calculemos, vendrá expresada igualmente en mm Hg, pero la temperatura tiene que
expresarse en Kelvin.
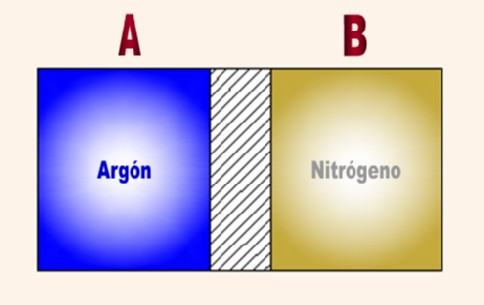
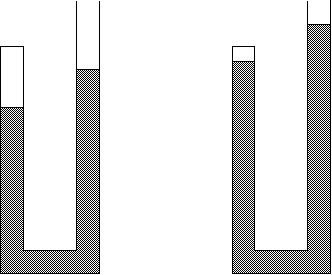
4.- Disponemos de un recipiente de volumen
variable. Inicialmente presenta un volumen de 500 cm3 y contiene 34
g de amoníaco. Si manteniendo constante la P y la T, se introducen 68 g de
amoníaco, ¿qué volumen presentará finalmente el recipiente?
Ar (N)=14. Ar (H)=1.
Manteniendo constante la P y la T, el volumen es
directamente proporcional al número de moles del gas. El mol de amoníaco, NH3,
son 17 g luego:
Inicialmente hay en el recipiente 34 g de gas que serán 2
moles y al final hay 192 g de amoníaco que serán 6 moles.
EJERCICIOS PROPUESTOS
5.- Un gas ocupa un volumen de 2 l en
condiciones normales. ¿Qué volumen ocupará esa misma masa de gas a 2 atm y
50ºC? R: 1,18lt
6.- Un recipiente cerrado de 2 l. contiene
oxígeno a 200ºC y 2 atm. Calcula:
a) Los
gramos de oxígeno contenidos en el recipiente.
b) Las moléculas de oxígeno presentes en el
recipiente.
Ar(O)=16.
R: a) 3,2 gr b) 6,023.1022 MOLECULAS DE O2
7.- Tenemos 4,88 g de un gas cuya naturaleza es SO2 o SO3. Para resolver la duda, los introducimos en un recipiente de 1 l y observamos que la presión que ejercen a 27ºC es de 1,5 atm. ¿De qué gas se trata?
Ar(S)=32.Ar(O)=16.
R: El gas es el SO3
8.-Un mol de gas ocupa 25 l y su densidad es
1,25 g/l, a una temperatura y presión determinadas. Calcula la densidad del gas
en condiciones normales.
R. 1,40 gr/L