El el tipo de Compuesto Químico que se Forma por la Unión Ionica de algún metal (electropositivo) y el oxigeno (electronegativo).
¿QUIENES SON METALES?
La mayor parte de los elementos metálicos exhibe el lustre brillante que asociamos a los metales. Los metales conducen el calor y la electricidad, son maleables (se pueden golpear para formar láminas delgadas) y dúctiles (se pueden estirar para formar alambres). Todos son sólidos a temperatura ambiente con excepción del mercurio (punto de fusión =-39 ºC), que es un líquido. Dos metales se funden ligeramente arriba de la temperatura ambiente: el cesio a 28.4 ºC y el galio a 29.8 ºC. En el otro extremo, muchos metales se funden a temperaturas muy altas. Por ejemplo, el cromo se funde a 1900 ºC.
Los metales tienden a tener energías de ionización bajas y por tanto se oxidan (pierden electrones) cuando sufren reacciones químicas.
LOCALIZACIÓN EN LA TABLA PERIÓDICA
Corresponde a los elementos situados a la izquierda y centro de la Tabla Periódica (Grupos 1 (excepto hidrógeno) al 12, y en los siguientes se sigue una línea quebrada que, aproximadamente, pasa por encima de Aluminio (Grupo 13), Germanio (Grupo 14), Antimonio (Grupo 15) y Polonio (Grupo 16) de forma que al descender aumenta en estos grupos el carácter metálico).
EL OXIGENO
Elemento químico gaseoso, símbolo O, número atómico 8 y peso atómico 15.9994. Es de gran interés por ser el elemento esencial en los procesos de respiración de la mayor parte de las células vivas y en los procesos de combustión. Es el elemento más abundante en la corteza terrestre. Cerca de una quinta parte (en volumen) del aire es oxígeno.
Existen equipos capaces de concentrar el oxígeno del aire. Son los llamados generadores o concentradores de oxígeno, que son los utilizados en los bares de oxígeno.
El oxígeno gaseoso no combinado suele existir en forma de moléculas diatómicas, O2, pero también existe en forma triatómica, O3, llamada ozono.
El oxígeno se separa del aire por licuefacción y destilación fraccionada. Las principales aplicaciones del oxígeno en orden de importancia son: 1) fundición, refinación y fabricación de acero y otros metales; 2) manufactura de productos químicos por oxidación controlada; 3) propulsión de cohetes; 4) apoyo a la vida biológica y medicina, y 5) minería, producción y fabricación de productos de piedra y vidrio.
CONFIGURACIÓN ELECTRONICA
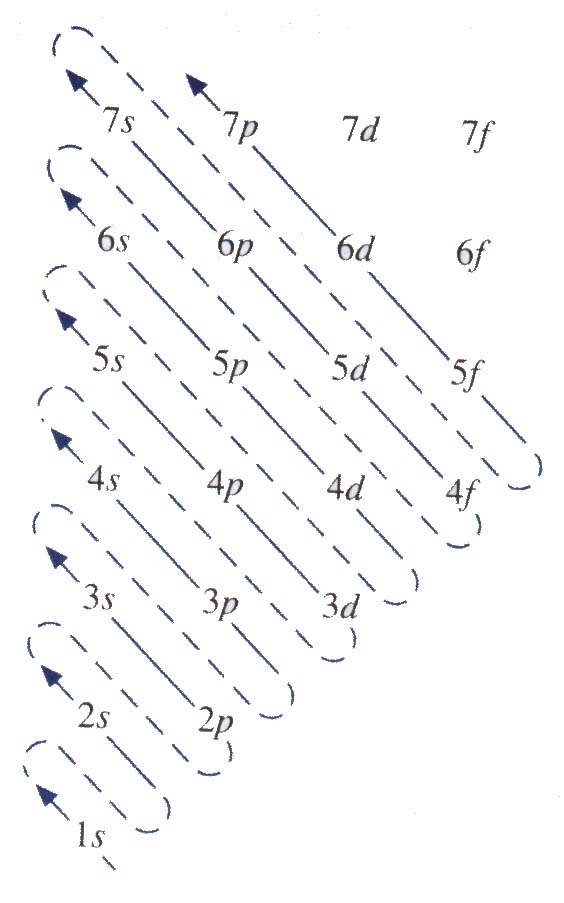
CONFIGURACIÓN ELECTRÓNICA DE METALES DE TRANSICIÓN
Los elementos del escandio (Z=21) al cobre (Z=29) pertenecen a los metales de transición. Los metales de transición tiene el subnivel d incompleto, o bien dan lugar a cationes que tienen el subnivel d incompleto. Considérese los metales de la primera serie de transición, del escandio al cobre. A lo largo de esta serie los electrones que se agregan se colocan en los orbitales 3d de acuerdo con la regla de Hund. Sin embargo hay dos irregularidades.
La configuración del cromo (Z=24) es [Ar] 4s13d5 y no [Ar] 4s23d4, como se esperaría. Se observa peculiar similitud en el cobre, cuya configuración electrónica es [Ar] 4s13d10 en lugar de [Ar] 4s23d9. Lo que ocurre es que la energía de los orbitales 3d y 4s se encuentran muy relacionadas entre sí. De manera ocasional, un electrón puede moverse desde uno de estos orbitales hasta el otro orbital. Este comportamiento anómalo se debe en particular a la estabilidad especial que se asocia a los orbitales degenerados que se encuentran llenos de manera incompleta.
Para los elementos del Zn (Z=30) al Kr (Z=36), las subcapas 4s y 4p se llenan en la forma indicada. En el rubidio (Z=37), los electrones empiezan a entrar en el nivel energético n=5 iniciando la quinta fila de la tabla periódica la cual es muy similar a la que precede. La sexta fila empieza muy parecida a la quinta fila: Un electrón en el orbital 6s del cesio (Cs) y dos electrones en el orbital 6s del bario (Ba). El siguiente elemento el latano (La) es un metal de transición.
Según el diagrama de llenado de los orbitales, después de llenar el orbital 5s se colocaran los electrones en el orbital 4f . En realidad las energías del 5d y el 4f están muy cerca, de hecho para el latano el 4f es ligeramente de mayor energía que el 5d. La configuración del latano es [Xe] 6s25d1y no [Xe] 6s24f1. Siguiendo al latano están los catorce elementos que conforman las tierras raras o lantánidos. Los metales de las tierras raras tiene incompletos los subniveles 4f o fácilmente dan lugar a cationes que tienen subniveles 4f incompletos. En esta serie, los electrones que se agregan se colocan en los subniveles 4f. Después de que se han llenado por completo el siguiente electrón entra en el subnivel 5d, lo que ocurre en el lutecio.
Nótese que la configuración electrónica del gadolinio (Z=64) es [Xe] 6s24f75d1 en lugar de [Xe] 6s24f8. De nueva se gana mayor estabilidad al tener subniveles semilleros (4f7) y ello favorece a esta configuración como en el caso del cromo.
Una vez completada la serie de los lantánido, siguen los metales de la tercera serie de transición incluyendo lantano y hafnio (Z=72) hasta oro (Z=79), que se caracterizan por el llenado de los orbitales 5d. A continuación se llenan los orbitales 6p que siguen hasta radón (Z=86).
La última fila de los elementos pertenece a la serie de los actínidos, la cual comienza con torio (Z=90). La mayoría de estos elementos no se encuentran en la naturaleza, sino que han sido sintetizados en reacciones nucleares.
Para nombrarlos se utilizan tres sistemas de nomenclaturas muy conocidas:
A) Sistemática: se utilizan los siguientes prefijos para indicar la cantidad de átomos de cada elemento que componen al óxido:
Mono = Si está una sola vez.
Di = si se repite dos veces
Tri = Tres veces
Tetra = Cuatro veces
Penta = Cinco veces
Hexa = Seis veces
Hepta = Siete veces
Por ejemplo: Fe2O3 : Trióxido de dihierro
CuO: Monóxido de cobre.
(se sobreentiende que al no colocar mono como prefijo, el elemento está una sola vez en la fórmula)
B) Stock: En esta nomenclatura se debe colocar el número de oxidación del elemento electropositivo (metal) en número romano dentro de un paréntesis.
Por ejemplo: Fe2O3 : Óxido de hierro (III)
CuO: Óxido de cobre (II)
C) Tradicional: En esta nomenclatura se utilizan prefijos y sufijos dependiendo del número de estados de oxidación que presente el elemento electropositivo (metal).
a) Si el elemento electropositivo presenta un sólo estado de oxidación: se coloca la palabra "Óxido de" seguido del nombre del elemento electropositivo en español. Por ejemplo:
CaO: Óxido de calcio.
Al2O3: Óxido de aluminio.
b) Si el elemento electropositivo presenta dos números de oxidación: Se coloca la palabra "Óxido" seguido de las terminaciones "oso" o "ico" al elemento electropositivo respectivamente (generalmente se utiliza el nombre en Latin del elemento menos la terminación "um o ium"). Por ejemplo: FeO : Óxido Ferroso.
Fe2O3 : Óxido Férrico.
c) Si el elemento electropositivo presenta tres números de oxidación: Se coloca "Óxido" seguido de:
c.1) Hipo+ nombre del metal en Latin menos su terminación "um o ium"+oso. Si es el menor número de oxidación.
c.2) Nombre del metal en Latin menos su terminación "um o ium"+oso. Si es el penúltimo número de oxidación.
c.3) Nombre del metal en Latin menos su terminación "um o ium"+ico. Si es el último número de oxidación.
Por ejemplo: CrO: Oxido hipocromoso.
Cr2O3 : Óxido cromoso.
CrO3 : Óxido crómico.
EJERICICIOS PROPUESTOS.
1- NOMBRE MEDIENTE LAS 3 NOMENCLATURAS LOS SIGUIENTES OXIDOS BÀSICOS:
1- FeO
2- MgO
3- CuO
4- MnO
5- CaO
6- K2O (el numero corresponde al subíndice)
7- ZnO
8- Na2O
9- Ag2O
10- Rb4O2
11- Sr2O2
2- MgO
3- CuO
4- MnO
5- CaO
6- K2O (el numero corresponde al subíndice)
7- ZnO
8- Na2O
9- Ag2O
10- Rb4O2
11- Sr2O2

0 comentarios:
Publicar un comentario